Hayes S.*, Kratzer U.**, Pfeifer B.***
*Central Baptist Hospital, Lexington, Kentucky, USA
** Urologische Spezialpraxis Trostberg, Deutschland
*** Aeskulap Krebs Zentrum, Brunnen, Schweiz
Zusammenfassung
ProstaSol, ein neues pflanzliches Präparat bestehend aus verschiedenen Sitosterolen, Quercetin, Pygeum, Sägepalme, Ginseng, Ingwer, Brenn-Nessel, Scutellaria und Reishi, wurde zur komplementären Behandlung von 96 Patienten mit hormon-refraktärem Prostatakrebs über einen Zeitraum von 8 Monaten getestet. ProstaSol wurde dabei in Kapselform und in absteigender Dosis von den Patienten eingenommen und die Auswirkungen auf das Verhalten der PSA-Werte, sowie auf Knochenschmerzen und allgemeine Lebensqualität untersucht. Es konnte gezeigt werden, dass die Einnahme von ProstaSol in der angegeben Dosierung zu einer Senkung des PSA Wertes von mehr als 50% des Ausgangswertes bei der Mehrzahl der Patienten führte. Gleichzeitig wurde eine Verbesserung der allgemeinen Lebensqualität und eine Reduktion von metastasen-bedingten Knochenschmerzen beobachtet.
Einleitung
Die Häufigkeit von Prostatakrebs ist in den letzten Jahren dramatisch gestiegen und dieser Trend wird weiter anhalten, da die Lebenserwartung der männlichen Bevölkerung steigt. Im Jahre 1997 wurden mehr als 335,000 neue Fälle allein in den USA diagnostiziert 1. Bei etwa 50% dieser Prostatakrebs-Patienten entwickelt sich im Verlaufe der Erkrankung ein unheilbares Leiden und bei etwa 10-20% dieser Patienten kann man Metastasierung schon bei der Diagnosestellung nachweisen 2.
Gegenwärtige Therapien für Prostatakrebs schließen die Operation (radikale Prostatektomie), Bestrahlung, Kryotherapie, und/oder Androgenablation, sowie reine Beobachtung („watchful waiting“) ein. Die Wahl der Therapieform richtet sich dabei nach dem PSA Spiegel, dem Differenzierungsgrad (Gleason Score) des Tumorgewebes, dem Tumorstadium, sowie dem allgemeinen Zustand, bzw. vorhandenen Begleiterkrankungen des Patienten. Bei metastasierter Erkrankung gibt es heute noch keine Heilung 3. Mit hormoneller Therapie mittels Orchiektomie (operative Entfernung der Hoden) oder LHRH Agonist und Anti-Androgen erreicht man oft nur eine kurzzeitige (Monate bis wenige Jahre) Tumorkontrolle. Die Langzeitresultate sind unbefriedigend und die meisten Prostatakrebs Patienten werden hormon-refraktär. Verschiede „Salvage-Methoden“ sind für diese Situation gegenwärtig in klinischer Prüfung, jedoch keine dieser Untersuchungen hat bisher signifikante Vorteile für Patienten nachweisen können. Wegen der Vielzahl unangenehmer Nebenwirkungen und der beklagten Unwirksamkeit der gegenwärtigen Therapien für das hormon-resistente Prostata-Karzinom suchen viele dieser Patienten nach Alternativen Behandlungsmethoden 4.
Das neue pflanzliches Mittel, ProstaSol, welches als Nahrungsergänzungsmittel auf dem Markt ist und verschiedene Sitosterole (Camposterol, Stimgasterol, Brassicasterol), Quercetin, Pygeum, Saw Palmetto, Ginseng, Ingwer, Brenn-Nessel, Scutellaria und Reishi enthält, hat in dieser Beziehung in den letzten 8 Monaten an Bedeutung gewonnen. Insbesondere, weil es ähnliche Wirkungen zeigt wie das bereits mehrere Jahre bekannte phytotherapeutische Mittel, PC SPES, welches seit einigen Monaten nicht verfügbar ist. ProstaSol soll entsprechend von Fallbeschreibungen zu deutlichen Reduktionen des PSA Wertes, sowie zur Abnahme von metastatisch – bedingter Schmerzen geführt haben. Dabei sollen außer einer verstärkten Sensibilität der Brustwarzen keine nennenswerten Nebenwirkungen aufgetreten sein. Immer mehr Patienten in den USA und Europa benutzen dieses Mittel zur komplementären Behandlung von Prostata-Krebs und anderen Prostataleiden, obwohl bislang weder klinische Daten zu Dosierung und Effektivität, noch Aussagen über mögliche Toxizität vorliegen. Wir haben deshalb diese prospektive Studie mit bei Patienten mit hormon-resistentem Prostata-Karzinom durchgeführt.
Methodik
Zwischen März und Dezember, 2001 haben 96 Patienten mit hormon-refraktärem Prostatakrebs nach Aufklärung ihr Einverständnis gegeben, an dieser Untersuchung teilzunehmen. Es sollten die Effekte einer 8-monatigen Einnahme von ProstaSol Kapseln auf den PSA Wert, auf krebsbedingte Schmerzen, sowie auf die Lebensqualität beurteilt werden. Urologen und Schmerztherapeuten verschiedener Einrichtungen in den USA und Europa haben diese Studie durchgeführt. Das Prostatakrebsleiden war bei allen Patienten durch Biopsie gesichert. Als hormon-refraktär wurde ein steter Anstieg des PSA Wertes bei drei hintereinander folgenden Messungen trotz hormoneller Therapie definiert. Die Anti-Androgen-Behandlung wurde bei diesen hormon-refraktären Patienten beibehalten, um den bekannten Effekt des Anti-Androgen-Entzugs auf den PSA Wert zu vermieden. Die Patienten wurden gebeten, ProstaSol zusätzlich zu ihrer bisherigen Therapie einzunehmen. Vor Beginn der Studie, sowie nach 4, 8, 12, 24, und 36 Wochen der ProstaSol – Einnahme erfolgte jeweils eine Beurteilung der Schmerzen und Lebensqualität, wie auch eine Blutuntersuchung zur Bestimmung des PSA Wertes, des Blutbildes und der Elektrolyte im Serum. Die Schmerzsituation wurde anhand einer Visuell-Analog-Skala (VAS) von 0-10 vom Patienten selbst eingeschätzt. Dabei war 0 als kein Schmerz und 10 als furchtbarer Schmerz definiert. Weiterhin wurde die Einnahmemenge an schmerzstillenden Mitteln (Narkotika und anti-entzündliche Medikamente) zu jedem oben genannten Zeitpunkt registriert. Veränderungen in der Lebensqualität wurden mit dem FACT-P (Version 3) Fragebogen 5 erfasst, welcher die physische, emotionale, soziale und funktionale Situation der Patienten in einer numerischen Antwort zusammenfasst. Mit 0 wird dabei kein Effekt, mit 10, ein maximaler Effekt auf einen bestimmten Bereich der Lebensqualität des Patienten beschrieben. Letztlich wurden die Patienten nach Auftreten von eventuellen Nebenwirkungen befragt. Nebenwirkungen und Toxizität wurden dabei mit den so genannten South West Oncology Group (SWOG) Toxicity Criteria 6 Fragebogen erfasst. Die Einnahmemenge von ProstaSol Kapseln wurde im Beobachtungszeitraum schrittweise reduziert, und zwar von 2800 mg pro Tag im ersten Monat, über 1800 mg pro Tag im zweiten Monat, zu 1200 mg im dritten Monat und schließlich auf 900 bis 1200 mg ab dem vierten Monat. Die Datenanalyse und statistische Auswertung erfolgte unter Verwendung des Mann-Whitney Rang-Summen Tests und Varianzanalyse, wobei die Patienten jeweils als ihre eigene Kontrolle dienten. Es wurden PSA Werte, sowie die numerischen Daten über Lebensqualität und Toxizität eines jeden Patienten vor, während und nach der ProstaSol – Einnahme miteinander verglichen. Alle vergleichenden Daten sind als Prozentabweichung von der Ausgangssituation dargestellt.
Ergebnisse
In der Tabelle 1 sind die demographischen Patientendaten zusammengefasst. Das mittlere Lebensalter der Patienten war 64.4 Jahre (Bereich 56-78 Jahre), ihr mittleres Körpergewicht lag bei 82 kg (Bereich 59 – 104 kg) am Anfang der Untersuchung und hat sich auf 78 kg (Bereich 58 – 96 kg) im Verlauf der Untersuchung reduziert. Alle Patienten waren mit standard-therapeutischen Maßnahmen vorbehandelt: 46 Patienten mit radikaler Prostatektomie, 24 Patienten mit Bestrahlung (Brachytherapie bzw. externe Bestrahlung), 12 mit kompletter Androgen-Blockade, 10 mit Orchiektomie, 4 Patienten mit Prostatektomie und späterer Bestrahlung. Bei 68 Patienten bestanden gleichzeitig Knochen – und Lymphknotenmetastasen, bei 23 Patienten waren nur Lymphknotenmetastasen bekannt, und bei 5 Patienten waren keine Metastasen nachgewiesen. Unter behandlungsbedürftigen, krebsbedingten Schmerzen litten 56 Patienten.
Tabelle 1: Patientendaten (Mittelwert, sowie minimal und maximal Werte)
| Mittelwert | Bereich | |
| Alter (Jahre) | 64.4 | 56 – 78 |
| Körpergewicht (kg) | 82.0 | 59 – 104 |
| Körpergröße (cm) | 178 | 169 – 200 |
Tabelle 2 fasst die ProstaSol Effekte auf die Schmerzintensität der Patienten zusammen. Es sind die Gruppenmittelwerte der VAS Scores für folgende Schmerzkategorien dargestellt: schlimmste Schmerzen, durchschnittliche Schmerzen, geringste und momentane Schmerzen. Die Einzelwerte für die Mittelung ergaben sich jeweils aus der individuellen Einschätzung der Patienten für einen Zeitraum von 7 Tagen vor dem entsprechenden Untersuchungstermin. Es zeigte sich, dass die VAS Scores für einzelne Schmerz-Kategorien unter der ProstaSol – Einnahme signifikant (p<0.05-0.01) abnahmen. Gleichzeitig ergab die Analyse des Schmerzmittelverbrauchs, dass unter ProstaSol 39 der 56 Patienten, die schmerzstillende Mittel benötigten, ihre Schmerzmitteleinnahme um etwa ein drittel reduzieren konnten.
| Tabelle 2: ProstaSol Effekte auf die Schmerzintensität | ||||||
| Schmerz -Kategorien | Wochen | |||||
| Ausgang | 4 | 8 | 12 | 24 | 36 | |
| Schlimmste Schmerzen | 100 | *79 +/-7 | *71 +/-5 | *74+/-5 | **57 +/-6 | *55 +/-6 |
| Durchschnittliche Schmerzen | 100 | *63 +/-4 | 63 +/-4 | *61 +/-6 | **48 +/-7 | 53 +/-8 |
| Momentane Schmerzen | 100 | **55+/-4 | **60+/-5 | *70+/-5 | *55+/-5 | *50+/-8 |
| Geringste Schmerzen | 100 | *46+/-9 | *44+/-8 | *51+/-11 | *45+/-6 | 48+/-7 |
Datenpaare wurden mittels Mann Whitney Rank Sum Test and Equal Variance Test (* = p<0.05; ** = p<0.01) analysiert. Dargestellte sind Mittelwerte +/- Standard Fehler der jeweiligen prozentualen Veränderungen vom Ausgangswert vor Behandlung
Ein positiver Einfluss der ProstaSol Einnahme auf die Lebensqualität der Patienten konnte im funktionellen und physischen Bereich der FACT-P (Version 3) Fragebogen Auswertung nachgewiesen werden. Danach hat sich die Lebensqualität der Patienten in Bezug auf das physische Wohlbefinden bei 58 der 96 befragten Patienten um wenigsten 30% gebessert. Das funktionelle Wohlbefinden wurde von 69 Patienten als verbessert angegeben. Diese Veränderungen waren signifikant (p<0.05). Die Lebensqualität in den emotionalen und sozialen Bereichen wurde von den Patienten als unverändert eingeschätzt.
Nebenwirkungen unter der ProstaSol Einnahme waren gering und bezogen sich auf eine erhöhte Empfindlichkeit der Brustwarzen im höheren Dosisbereich während der ersten beiden Monate der Einnahme bei 43 Patienten, Völlegefühl bei 17 Patienten und kurzzeitiger Durchfall bei 6 Patienten. Es traten weder signifikante Veränderungen im Blutbild oder den Serum – Elektrolyten auf, noch wurden über oberflächliche oder tiefe Beinvenenthrombosen berichtet.
Die ProstaSol Einnahme war verbunden mit einer signifikanten (p<0.01-0.001) Abnahme der PSA Werte. Der mittlere PSA Spiegel vor der ProstaSol Einnahme lag bei 87 ng / ml (Bereich 16-203 ng / ml). Ein mittlerer PSA Nadir von 41 ng / ml wurde nach etwa 10-12 Wochen der ProstaSol Einnahme erreicht. Zwölf Patienten haben den PSA Nadir bereits nach 8 Wochen erreicht. Bei 65 von 96 Patienten (68%) fiel der PSA Wert um mehr als die Hälfte im Vergleich zum Ausgangswert. Bei 24 Patienten kam es nach einer kurzzeitigen PSA-Reduktion von etwa 3-4 Monaten zu einem erneuten Ansteigen der PSA Werte, bei einigen Patienten bis hin zum Ausgangsniveau.
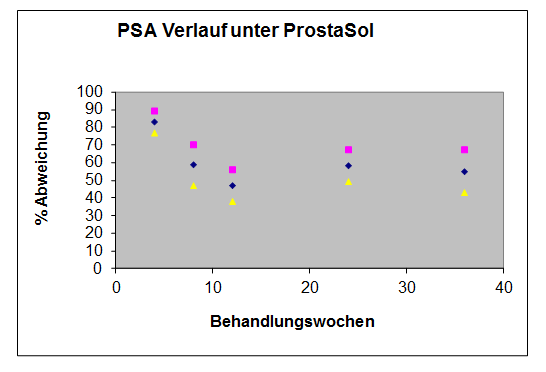
Abbildung 2 zeigt die Effekte von ProstaSol auf den PSA-Wert Verlauf. Dargestellt sind die Gruppenmittelwerte (+/- Standardfehler) für die prozentualen Veränderungen im Vergleich zum Ausgangswert.
Diskussion
Patienten mit einem hormon-refraktärem Prostatakrebs haben eine mittlere Überlebensdauer von etwa 6-12 Monaten 7. Gegenwärtige Möglichkeiten der Behandlung haben bisher nur palliativen Charakter, ohne die Überlebenszeit der Patienten zu erhöhen 7. Die meisten dieser Therapien haben außerdem signifikante Nebenwirkungen, die von Patienten oft nicht akzeptiert werden. Viele Patienten in dieser Situation suchen daher oft nach alternativen Behandlungen, darunter auch pflanzliche Heilmittel 4, 16. ProstaSol wird in diesem Sinne seit etwa einem Jahr in der Therapie des Prostata-Karzinoms eingesetzt. Einige Patienten haben unter der Einnahme dieses Präparates von sehr positiven Wirkungen berichtet. Die Resultate der vorliegenden Untersuchung belegen einige dieser positiven Wirkungen. Die signifikante Abnahme krebsbedingter Schmerzen und die Tendenz der Patienten, weniger Schmerzmittel zu benötigen, sprechen für eine schmerzlindernde Wirkung durch ProstaSol. Da das Produkt keine analgetische Beimischung enthält, muss der beobachtete Effekt durch direkte Wirkung von ProstaSol Bestandteilen erklärt werden. So ist zum Beispiel von Pygeum, Reishi (Ganoderma lucidum), Ingwer und Panax pseudo-ginseng bekannt, dass sie anti-entzündliche und analgetische Wirkung besitzen. Die Abnahme krebsbedingter Schmerzen war bei diesen Patienten auch mit einer Verbesserung der allgemeinen Lebensqualität verbunden. Verbesserung der Gehfähigkeit beim Patienten mit Knochenscherzen, mehr Energie und verbesserter Appetit standen dabei im Vordergrund und wurden von etwa 60% der Patienten berichtet.
Der beobachtete Abfall der Blut-PSA-Werte bei etwa zweidrittel dieser Patienten spricht für eine Unterdrückung der PSA – Produktion und/oder Freisetzung aus der Prostatazelle und legt damit eine Verlangsamung der Zellteilung im Prostatagewebe durch ProstaSol nahe. Es gilt daher als wahrscheinlich, dass dieses Mittel die Zellteilung im Tumorgewebe hormon-refraktärer Prostatakrebs-Patienten vermindert. Aus der experimentellen Forschung ist für die meisten Bestandteile von ProstaSol nachgewiesen, dass diese Krebswachstum hemmen können und in der Lage sind, Apoptose von Prostatakrebszellen zu erzwingen. So haben Chan et al 8 beispielsweise erst vor kurzem zeigen können, dass Extrakte aus Scutellaria das Flavonoid Baicalin enthalten, welches in niedrigster Konzentration bereits 50% Apoptose bei DU145 Prostatakrebszellen erzeugt.
Zu ähnlichen Ergebnissen kommen auch Hsieh und Wu 9 in Untersuchungen mit Prostatakrebszellkulturen, bei denen Scutellaria Extrakte eine mehr als 60%-ige Hemmung des Krebszellwachstums von LnCaP Zellen bewirkte und die PSA Produktion dieser Zellen deutlich unterdrückte. Auch vom Extrakt der Brenn-Nessel ist bekannt, dass dieser eine Wachstumshemmung von Prostata-Krebszellen bewirken kann. Lichius et al 10 haben dies für die Polysaccharid Fraktion einer 20%-igen methanolischen Extraktion aus der Brenn-Nessel-Wurzel nachgewiesen und zeigen können, dass diese das Wachstum von Prostata-Karzinomzellen aus Lymphknotenmetastasen um 50% hemmt. Auch von anderen Bestandteilen von ProstaSol sind Antitumorwirkungen bekannt. Von Ganoderma ist beispielsweise beschrieben worden, dass es seinen anti-tumor Effekt über die Freisetzung von Zytokinen (TNF-alpha und INF-gamma) 11 entfaltet. Von Knowles et al 12 ist berichtet worden, dass bereits 100 Mikromol Quercetin zu einer kompletten Wachstumshemmung bei hormon-resistenten Prostata- Krebszellen (PC-3 Zellkultur) führt. Schließlich ist durch Surh 13 bekannt geworden, dass die im Ingwer enthaltenen Phenole, 6-Gingerol und 6-Paradol, deutliche anti-tumor Wirkung entfalten. Liu et al 14 haben zeigen können, dass Saponin und Ginsenosid (Rg-3), extrahiert aus Ginseng, eine ausgeprägte Hemmung von Prostatakrebszellen bewirkt, die mit einer Abnahme der PSA Produktion, sowie einer Hemmung der Androgen-Rezeptoren einhergeht. Weiterhin erzeugte Ginsengextrakt klassische Apoptose durch Hemmung der bcl-2 Gen-Aktivität. Das metastatische Potential der der Prostatakrebszellen wurde durch Ginsenosid deutlich unterdrückt. Iguchi und Mitarbeiter 15 konnten eine ähnlich starke apoptotische Wirkung auch von Serenoa Repens Extrakt nachweisen, welcher zumindest zum Teil auf der zytotoxischen Wirkung von Myristolsäure basiert.
Nebenwirkungen in dieser Untersuchung beschränkten sich auf Völlegefühl, insbesondere bei der höheren Anfangsdosis bei 18 Patienten (19%), Durchfall in den ersten zwei Wochen der Einnahme bei 11 Patienten (12%), und erhöhte Sensibilität und geringe Schwellung der Brustwarzen bei 32 Patienten (33%). Andere Nebenwirkungen, insbesondere Thrombosen sind bei diesen Patienten nicht beobachtet worden. Daraus lässt sich ein sehr vertretbares Nebenwirkungsprofil für ProstaSol ableiten.
Wie lange die durch ProstaSol erzeugte Krebswachstumshemmung andauert, ist mit dieser Untersuchung nicht zu entscheiden. Bei 24 der behandelten Patienten kam es nach einem anfänglichen guten PSA Abfall bereits nach 4 Monaten wieder zu einem erneuten Anstieg des Wertes. Auf der anderen Seite weisen immerhin 41 der insgesamt 96 Patienten auch nach 8 Monaten noch eine anhaltende Erniedrigung ihrer PSA Werte auf, was weitere Untersuchungen dieses neuen Mittels sicherlich rechtfertigt.
Literatur
- Parker, S.L., Tong, T., Bolden, S., Wingo, P.A.: Cancer statistics, 1997. CA Cancer J Clin 47: 5, 1997
- Klien, L.A.: Prostatic carcinoma. N Engl J Med 300: 824, 1979
- Waselenko, J.K., Dawson, N.A.: Management of Progressive Metastatic Prostate Cancer. Oncology 11: 1551, 1997
- Eisenberg, D.M., Kessler, R.C., Foster, C., Norlock, F.E., Calkins, D.R., Delbanco, T.L.: Unconventional medicine in the United States: prevalence, costs, and patterns of use. N Engl J Med 328: 246, 1993
- Esper, P., Mo, F., Chodak, G., Sinner, M., Cella, D., Pienta K.J.: Measuring Quality of Life in Men with prostate Cancer using Functional Assessment of Cancer Therapy – Prostate Instrument. Urology 50:920, 1997
- Green, S., Weiss, G.R.: Southwest Oncology Group standard response criteria, endpoint definitions and toxicity criteria. Investigational New Drugs 10:239, 1992
- Waselenko, J.K., Dawson, N.A.: Management of Progressive Metastatic Prostate Cancer. Oncology 11: 1551, 1997
- Chan FL, Choi HL, Chen ZY, Chan PS, Huang Y.:Induction of apoptosis in prostate cancer cell lines by a flavonoid, baicalin. Cancer Lett 160(2):219, 2000
- Hsieh TC, Wu JM.Mechanism of action of herbal supplement PC-SPES: Elucidation of effects of individual herbs of PC-SPES on proliferation and prostate specific gene expression in androgen-dependent LNCaP cells. Int J Oncol 20(3):583, 2002
- Lichius JJ, Lenz C, Lindemann P, Muller HH, Aumuller G, Konrad L.: Antiproliferative effect of a polysaccharide fraction of a 20% methanolic extract of stinging nettle roots upon epithelial cells of the human prostate (LNCaP). Pharmazie 54(10):768, 1999
- Wang SY, Hsu ML, Hsu HC, Tzeng CH, Lee SS, Shiao MS, Ho CK.:The anti-tumor effect of Ganoderma lucidum is mediated by cytokines released from activated macrophages and T lymphocytes. Int J Cancer 70(6):699, 1997
- Knowles LM, Zigrossi DA, Tauber RA, Hightower C, Milner JA.: Flavonoids suppress androgen-independent human prostate tumor proliferation. Nutr Cancer 38(1):116, 2000
- Surh Y.: Molecular mechanisms of chemopreventive effects of selected dietary and medicinal phenolic substances. Mutat Res 428(1-2):305,1999
- Liu WK, Xu SX, Che CT.: Anti-proliferative effect of ginseng saponins on human prostate cancer cell line. Life Sci 67(11):1297, 2000
- Iguchi K, Okumura N, Usui S, Sajiki H, Hirota K, Hirano K.: Myristoleic acid, a cytotoxic component in the extract from Serenoa repens, induces apoptosis and necrosis in human prostatic LNCaP cells. Prostate 47(1):59, 2001
- Risberg, T., Lund, E., Wist, E. Kaasa, S., Wilsgaard, T.: Cancer patients use of nonproven therapy: A 5-year follow-up study. J Clin Oncol 16:6, 1998
